Szinte valamennyien büszkén tekintünk az elmúlt néhány évtized szédületes technológiai fejlődésére, csodálattal töltenek el bennünket a modern technika legújabb vívmányai, például az űrsiklók és szuperszámítógépek. S mégis, ha jobban belegondolunk, az elmúlt harmincezer év technológiáink alapvető megközelítési módjában nem sok újdonságot hozott. Meglepőnek tűnhet ez az állítás, de vegyük alaposabban szemügyre, hogy mit tudott az ősember, s mit tudunk mi ma. Őseink agyagedényt égettek, képeket mázoltak a barlang falára, dárdahegyet pattintottak. A legfejlettebb technológiáink között számon tartott mikroelektronika lényegében ugyanezt teszi: a szilíciumlapkát olvasztással, kristályosítással nyerjük, a felületére – ugyan fénnyel, s nem széndarabbal – mintákat rajzolunk, aztán a mintákat kimaratjuk, ami a pattintással rokonítható művelet. Persze az idők folyamán mégiscsak hatalmas előrehaladás történt, aminek a lényege valójában az, hogy amíg az ősember egy lépésben trilliószor billió atomot mozgatott meg, addig mi már kifinomult módszereinkkel képesek vagyunk „csupán” néhány milliárdot manipulálni egyszerre. De ahelyett hogy jól kézben tartott építkezés folyna, sokszor inkább irányított rombolásról beszélhetünk. Az anyagot felépítő részecskék egyenkénti elrendeződésének precíz kontrolljára egészen a legutóbbi időkig nem voltunk képesek.
A technológiai fejlődés eredményeként egyre parányibb objektumokat állítunk elő. A legújabb Pentium chipeken 70-80 nm-es tranzisztorok milliárdjai találhatók. Általános értelemben a 100 nm alatti mérettartományban működő technológiákat hívjuk nanotechnológiának. Láthatjuk, hogy a hagyományos technológiák folyamatos miniatürizálása mostanára a nanotechnológia megjelenéséhez vezetett.
A nanométeres mérettartomány az atomok és molekulák birodalma. A nanométeres méretskála megfelel a hajszál vastagsága százezred részének, de ezerszer kisebb még a baktériumok méreténél is. De mégsem a parányi méretek jelentik majd az igazi újdonságot a nanotechnológiában. Eddig fentről lefelé haladtunk, mintegy kívülről próbáltuk meg befolyásolni és átformálni az anyag tulajdonságait. Azonban a hagyományos technológiák további miniatürizálása helyett miért ne próbálkozhatnánk meg végre valami gyökeresen újfajta megközelítéssel? Miért ne indulhatnánk el alulról, atomokból és molekulákból építve parányi gépezeteket? Ez a fajta nanotechnológia, amit nevezzünk molekuláris nanotechnológiának, számos előnnyel kecsegtet. Ha atomokból építkezünk, olcsó technológiához jutunk, hiszen a nyersanyagforrások atomi szinten kimeríthetetlenek. Ha irányított módon alulról rakunk össze mindent, akkor nem keletkezik melléktermék, azaz rendkívül környezetkímélő technológiához jutunk. Az előállított objektumokat a parányi méret s az ebből fakadó gyors működés jellemzi majd.
Mindenfajta technológia alapvető célja, hogy olyan objektumokat hozzon létre, amelyek a mi makroszkopikus világunkban idéznek elő kívánt változásokat. Ha csupán kis számú nanométeres objektumot építünk, attól nem várható észrevehető makroszkopikus hatás. Valószínűleg molekuláris gépezetek milliárdjait kell létrehoznunk ahhoz, hogy számottevő befolyással legyenek a mi világunkra. Éppen ezért rendkívül fontos lenne, hogy olyan molekuláris gépezeteket állítsunk elő, amelyek rendelkeznek a gyors megsokszorozódás, azaz az önreprodukció képességével is. S milyen nagyszerű volna, ha parányi gépezeteink képesek volnának az önszerveződésre is, azaz elég lenne csupán legyártanunk az alkatrészeket, s azok minden további beavatkozás nélkül összeállnának működőképes rendszerekké.
Vajon egy ilyen, önszerveződő és önreprodukáló molekuláris gépezeteket létrehozó nanotechnológia rendelkezik-e bármiféle realitással, vagy mindez vágyálom csupán? Szerencsére tudjuk a választ. Hiszen a molekuláris nanotechnológia egyáltalán nem új dolog, az élő szervezetek molekuláris nanotechnológiát alkalmaznak, bennük elsősorban fehérjékből felépülő molekuláris gépezetek működnek. A 4,5 milliárd éves földi evolúció eredményeként kialakult élő szervezetek fehérjéi rendkívül szerteágazó feladatok ellátására képesek. Bár saját nanotechnológiánk kifejlesztéséhez sokféle úton elindulhatnánk, de ha már az orrunk előtt van egy jól működő fehérje alapú molekuláris nanotechnológia, van honnan ellesnünk trükköket, működési elveket, akkor célszerű ebből kiindulnunk.
Fehérjék
A fehérjék az élő szervezetek legfontosabb anyagai. De úgy is fogalmazhatnánk, hogy a fehérjék olyan kivételes tulajdonságokkal rendelkező molekulák, amelyekből akár élő rendszerek is építhetők. A fehérjék óriásmolekulák, több ezer, esetenként több tízezer (elsősorban szén-, hidrogén-, oxigén-, nitrogén- és kén-) atomból állnak. A fehérjék valójában lineáris polimerek (láncmolekulák), amelyek 20-féle aminosav összekapcsolódásával jönnek létre. Minden aminosav azonos vázból és egy ahhoz csatlakozó egyedi oldalláncból épül fel. Az aminosavak azonos részeiken keresztül peptidkötéssel egymáshoz kapcsolódva alkotják a fehérjék polipeptidláncait, amelyek általában több száz aminosavból állnak. A polipeptidláncok váza periodikus szerkezet, amelyet a kapcsolódó oldalláncok tesznek változatossá.
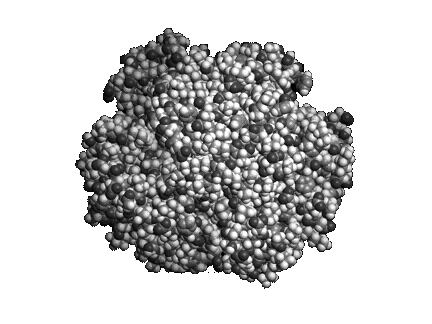
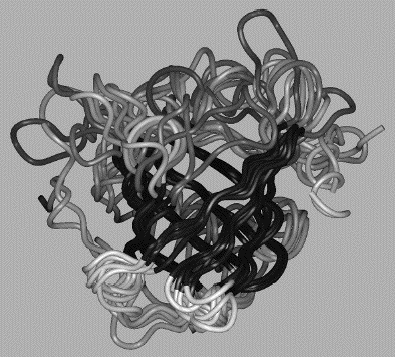
Mitől különlegesek a fehérjék? Bár az ember is képes különféle lineáris polimereket szintetizálni, több lényegi különbség van a fehérjék és a mesterséges polimerek között. A fehérjék aminosavszekvenciája, s ezáltal méretük és tömegük szigorúan meghatározott. Míg a mesterséges polimerek oldatban nem rendelkeznek határozott térszerkezettel, s nagyszámú konformáció között véletlenszerűen csaponganak, addig a fehérjék polipeptidlánca képes feltekeredni, és felvenni egy jól definiált, kompakt térszerkezetet (1. ábra). A fehérjék feltekeredettsége, jól definiált térszerkezete teszi lehetővé, hogy változatos funkciókat lássanak el.
1. ábra A hemoglobin oxigénszállító fehérje térszerkezete
A fehérjék kompakt térszerkezete a látszat ellenére egyáltalán nem statikus szerkezet. A fehérjék örökös mozgásban, nyüzsgésben vannak, egyes részeik különböző időtartományokban lejátszódó mozgásokban vesznek részt. Ezek a mozgások rendkívül széles időskálát ölelnek fel, a pikoszekundumos (10-12 s) tartománytól akár az éves (106 s) időtartamokig, s az atomi rezgésektől és az oldalláncok gyors rotációs mozgásától a neurodegeneratív betegségek (prionbetegségek) hátterében álló lassú konformációs átrendeződésekig terjednek. A fizika törvényei szerint a molekuláris mozgások valójában elkerülhetetlenek. A fehérjékben egy hosszú evolúciós folyamat eredményeként ezek a konformációs fluktuációk irányítottan mennek végbe, s amint arra a következő fejezetben több példát is láthatunk majd, a fehérje egyes részeinek öszszehangolt, irányított mozgásai gyakran meghatározó szerepet játszanak a fehérjék működésében.
Molekuláris gépezetek
Miért érdekesek a fehérjék? Mert, amint azt az élő szervezetek esetében láthatjuk, önszerveződő molekuláris gépezetek építhetők belőlük. Az önszerveződés alatt azt értjük, hogy az egyes fehérjealegységek (alkatrészek) képesek felismerni egymást, meghatározott módon egymáshoz kapcsolódni, s minden külső beavatkozás nélkül létrehozni az adott szupramolekuláris struktúrát. Az élő szervezetekben található molekuláris gépezetek rendkívül változatos funkciók ellátására képesek. Találhatók közöttük:
- molekuláris vegyi üzemek;
- energiaátalakítók és motorok;
- jelfelismerők és információfeldolgozó rendszerek;
- programvezérelt összeszerelők.
Az enzimek olyan fehérjemolekulák, amelyek képesek egy-egy adott kémiai reakciót akár több milliárdszorosára felgyorsítani. Az enzimek sokszor egymáshoz kapcsolódva, egymással együttműködve összetett rendszereket alkotnak, amelyek végtermékeiket egymásnak átadva bonyolult reakciósorozatok véghezvitelére képesek. A fehérjék szerkezeti dinamikája döntően befolyásolja az enzimatikus folyamat hatékonyságát. A fehérjék azért sokkal hatékonyabbak pl. a szervetlen katalizátoroknál, mert a működésük során dinamikus tulajdonságaik miatt szerkezetük folyamatosan idomulni képes a változó követelményekhez. Képesek felismerni és erősen megkötni az átalakítandó szubsztrátot. A szubsztrát bekötődése olyan konformációs átrendeződést idéz elő, amely lehetővé teszi – az energiagátat lecsökkentve – az átmeneti termék erős kötését is, majd a kémiai reakció megtörténte után bekövetkező relaxációs folyamatok eredményeként képes könnyen elereszteni a végterméket, lehetővé téve az újabb katalitikus ciklus megkezdését.
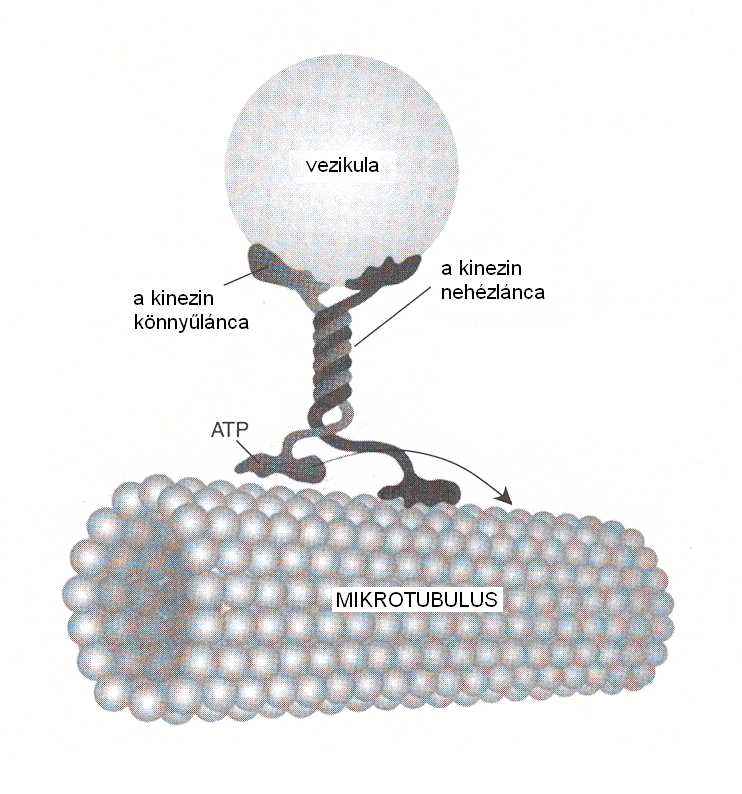
Az élő szervezetekben többféle energiaátalakító rendszerrel találkozhatunk, amelyek a fényenergia, kémiai és mechanikai energia egymásba alakítását végzik. A fotoszintetikus reakciócentrumok pl. nagy hatékonysággal alakítják át a fényenergiát kémiai energiává. Az így nyert energia végül energiadús vegyületek (ATP, NADH) formájában tárolódik. Az izmokban pedig kémiai energia felhasználásával történik mechanikai munkavégzés. Valójában a sejtekben található energiaátalakítók közé tartoznak a molekuláris motorok is. Lineáris motorként működik pl. a kinezin fehérje, amely a sejtek vázát alkotó mikrotubulusok mentén haladva képes hasznos terhet szállítani (2. ábra). A molekula két lábdoménjével felváltva lépeget, minden egyes lépéshez egy-egy energiadús ATP molekula elbomlása biztosítja az energiát. A kinezin lépéseinek hossza 8 nm, átlagos mozgási sebessége 160 nm/s. A mai legmodernebb méréstechnikákkal akár egyetlen – pl. fluoreszcens festékkel megjelölt – molekula mozgása is megbízhatóan nyomon követhető. Számos egyéb lineáris motorként működő fehérjét ismerünk, az izmok működése is azon alapul, hogy a miozin molekulák képesek mozogni az aktinszálak mentén.
De fehérjékből nemcsak lineáris, hanem rotációs motorok is építhetők. A baktériumok mozgásszervei a flagellumok, amelyek sejtmembránba ágyazott része magában foglal egy parányi, 50 nm átmérőjű, protonok által hajtott motort. Minden egyes motorhoz egy-egy 5-10 mm hosszúságú helikális filamentum csatlakozik, amely a flagellin fehérje több tízezer kópiájából épül fel. Ezek a helikális filamentumok a baktérium úszása során egyetlen nagy helikális köteggé állnak össze, amely tengelye körül forogva mintegy propellerként hajtja előre a baktériumot. A flagelláris motorok morfológiájukat tekintve nagyon hasonlítanak az ember által készített elektromotorokhoz, hengerszimmetrikus szerkezetűek, álló- és forgórészből állnak. Akár 90 ezres percenkénti fordulatszám elérésére is képesek, amely többszörösen meghaladja az F–1-es versenyautók motorjainak fordulatszámát. Hatékonyságukat jellemzi, hogy egyetlen körülforduláshoz csupán 500-1000 protont használnak fel.
A fehérjék rendkívül sok specifikus molekula felismerésére képesek, aminek fontos szerepe van a környezettel való kommunikációban és az idegen anyagok elleni védekezésben is. A magasabb rendűek immunrendszerének működése azon alapul, hogy az immunglobulin molekulák akár több millióféle idegen molekulát képesek megbízhatóan felismerni. Valójában a természet nagyszámú immunglobulin variánst generál, amelyek abban különböznek egymástól, hogy egy adott felületi régiójuk aminosavszekvenciája eltér egymástól, ezáltal különféle kötőfelületek jönnek létre. Ezen véletlenszerűen generált kötőfelületek között – a tapasztalat szerint – mindig található olyan, amelyik képes az idegen makromolekula, vírus vagy sejt valamelyik felületi régiójához specifikusan és erősen kötődni.
Fehérjékből és nukleinsavakból programvezérelt összeszerelő rendszerek is építhetők. Ilyenek pl. a riboszómák, amelyek a sejtekben a fehérjék szintézisét végzik. A DNS-ben tárolt információt hordozó hírvivő ribonukleinsav (RNS) molekulákat megkötve, az általuk hordozott lineáris információ alapján képesek legyártani a megfelelő fehérjét. Valójában az RNS molekula hordozza azt a digitális programot, amely vezérli a riboszóma működését. A riboszómák két alegysége három hatalmas RNS molekulából és több mint 50 fehérjekomponensből épül fel. A riboszóma a legnagyobb molekuláris komplexum, amelynek szerkezetét atomi precizitással ismerjük. Ezek az óriási szupramolekuláris rendszerek is rendelkeznek az önszerveződés képességével, alkotóelemeikből, azokat megfelelő sorrendben és körülmények között összekeverve, kémcsőben is rekonstruálhatók.
Vajon miért alkalmasak a fehérjék önszerveződő molekuláris gépezetek építésére? A válasz kissé paradox: mert a fehérjék megfelelően nagyok, s ugyanakkor elég kicsik is. A fehérjék kiterjedt felszínén több könnyen felismerhető régió található, amelyeken keresztül specifikusan képesek más fehérjékhez (molekulákhoz) való kapcsolódásra. A fehérje-kölcsönhatásokban részt vevő kontaktfelszínek alakjukat és kölcsönhatási mintázatukat tekintve is komplementerek egymással. Ennek eredménye az, hogy csak a meghatározott partnerrel, szigorúan meghatározott szerkezetű komplexumot alkotva jön létre a kölcsönhatás. Ugyanakkor a fehérjék kis mérete miatt a véletlenszerű hőmozgások (Brown-mozgás) nagyon intenzívek, másodpercenként több tízmilliárdnyi relatív konformáció kipróbálására nyújtva lehetőséget. Ez magyarázza, hogy a fehérje alapú molekuláris gépezetek alegységei miként képesek a megfelelő módon, minden külső beavatkozás nélkül gyorsan összekapcsolódni.
Lehetséges-e jobb fehérjéket eloállítani?
A bemutatott példák alapján láthatjuk, hogy az élő rendszerekben található fehérjék fantasztikus dolgokra, rendkívül szerteágazó feladatok ellátására képesek. Kézenfekvő a kérdés, hogy miként használhatnánk fel őket a saját céljainkra. De előtte érdemes végiggondolnunk, hogy van-e esély esetleg még a létezőknél is jobb fehérjéket előállítani.
Végezzünk egy rövid számítást, s becsüljük meg, hogy egy átlagos méretű, 300 aminosavból álló fehérjéből hány különböző, azaz eltérő aminosavszekvenciájú fehérjét lehetne előállítani. Minthogy a szekvencia minden egyes pozíciójában 20-féle aminosav közül szabadon választhatunk, a lehetséges szekvenciák száma:
N = 20 . 20 . 20 . ... . 20 = 20300 ≈ 10390 db
Gigantikus számot kaptunk. Összehasonlításként számítsuk ki az Univerzum köbnanométerben mért térfogatát:
az Univerzum mérete ≈ 15 milliárd fényév ≈ 3.1035 nm;
vagyis:
az Univerzum térfogata ≈ 10106 nm3
Egy fehérje átlagos térfogata néhány köbnanométer. Az ismert Univerzum köbnanométerben mért térfogata eltörpül a lehetséges fehérjeszekvenciák száma mellett. Másképpen fogalmazva, ha képesek lennénk szintetizálni a lehetséges fehérjeszekvenciákat, akkor azok egy parányi töredékével zsúfolásig teletömhetnénk az Univerzumot. Figyelembe véve, hogy Világegyetemünket meglehetősen ritkán tölti ki az anyag, azt kell mondanunk, hogy ha az összes létező anyagot fehérjék szintézisére használnánk, akkor is csak egy elenyésző töredékét gyárthatnánk le a lehetséges szekvenciáknak.
A földi evolúció számára még sokkal korlátozottabb anyagmennyiség állt rendelkezésre. Az eltelt 4,5 milliárd év során a Földön a lehetséges fehérjeszekvenciák csak egy hihetetlenül parányi töredékének kipróbálására nyílt lehetőség. És ebből a parányi töredékből ámulatba ejtő tulajdonságú molekuláris gépezeteket lehetett konstruálni, olyan komplex rendszereket lehetett építeni, mint amilyenek pl. a baktériumok, halak, kutyák vagy emberek. Ha képesek lennénk tudatos fehérjetervezésre, ha meg tudnánk mondani, hogy egy adott aminosavszekvencia milyen térszerkezetet képes felvenni, s az milyen funkciót láthat el, akkor minden bizonnyal a természetben létező fehérjéknél jóval változatosabb és előnyösebb tulajdonságokkal rendelkező fehérjéket állíthatnánk elő.
A bio-nanotechnológia fejlodése
A nanotechnológia alapvető célkitűzése, hogy alulról, atomokból, ill. molekulákból építkezve hozzon létre működőképes rendszereket. A fenti példák is mutatják, hogy a nanotechnológia kifejlesztésénél nem kell mindent magunknak kitalálnunk. Az élő szervezetek példája azt mutatja, hogy a fehérjék kiválóan alkalmasak önszerveződő molekuláris gépezetek építésére. Vajon miként használhatnánk fel őket a saját céljainkra?
A fehérje alapú nanotechnológia fejlődésének lehetséges forgatókönyve az alábbi lépéseken keresztül képzelhető el:
- az élő rendszerekben található molekuláris gépezetek szerkezetének, működési mechanizmusának felderítése;
- a meglévő fehérjék tulajdonságainak célzott módosítása;
- fehérjetervezés;
- fehérjékből álló komplex rendszerek tervezése;
- programvezérelt összeszerelő rendszerek létrehozása.
Az elmúlt három évtized intenzív kutatásainak eredményeként az élő szervezetekben található molekuláris gépezetek szerkezetéről és működéséről már meglehetősen sok ismerettel rendelkezünk. Elsősorban röntgendiffrakciós szerkezetvizsgálatok révén manapság közel harmincezer fehérje szerkezetét ismerjük atomi precizitással – bár ezek között sok rokon fehérje is található, amelyek különböző élőlényekben látnak el azonos funkciót. Összehasonlításképpen talán elég arra gondolnunk, hogy egy emberi sejtben kb. ötvenezer különféle fehérje működik. Az összes felderített szerkezet a brookhaveni fehérjeadatbankban (http://www.pdb.org) megtalálható. Ez a hatalmas adathalmaz már elegendő információt hordoz ahhoz, hogy a fehérjék szerkezetének és működésének alapvető elveit megérthessük, s hozzáláthassunk a természetben található fehérjék saját céljainkra való átalakításához.
Az egyes fehérjék aminosavsorrendjét meghatározó információt a DNS molekula egy darabja tárolja, amelyet génnek nevezünk. Az élő szervezetekben található fehérjéket, pontosabban azok aminosavszekvenciáit ma már képesek vagyunk a génsebészet módszereivel szinte tetszés szerint átalakítani. A problémát inkább az jelenti, hogy minél több aminosavat cserélünk ki, annál kevésbé tudjuk megjósolni a módosítások térszerkezeti következményeit.
A természetes fehérjék szerkezetének vizsgálata során felismert összefüggések, törvényszerűségek, szerveződési elvek sokat segítenek abban, hogy egy fehérje szerkezetében vagy tulajdonságaiban célzott módosításokat idézhessünk elő. Ma már viszonylag egyszerű feladatnak számít megnövelni egy fehérje hőstabilitását, megváltoztatni pH-toleranciáját, kötődési jellemzőit, az optimális működés feltételeit, módosítani katalitikus tulajdonságait. Módosított fehérjékkel hétköznapjainkban is gyakran találkozhatunk, mosóporaink pl. olyan enzimeket tartalmaznak, amelyek 90 ºC-on, erősen lúgos körülmények között is kiválóan működnek.
Természetesen a meglévő fehérjék tulajdonságainak módosításán túlmenően az igazi kihívást a mesterséges fehérjék tervezése és létrehozása jelenti. A fehérjék tervezése még gyerekcipőben jár. Attól nagyon távol állunk, hogy egy adott aminosavszekvenciáról meg tudnánk mondani, hogy egyáltalán képes-e, ill. milyen szerkezetté képes feltekeredni, s a feltekeredett szerkezet rendelkezik-e bármiféle hasznos funkcióval.
A tervezés nehézségét valójában az jelenti, hogy egy fehérje lehetséges konformációinak száma óriási. Ennek érzékeltetésére végezzünk ismét egy egyszerű számítást:
Tekintsünk egy átlagos méretű, 300 aminosavból álló fehérje polipeptidláncát. A polipeptidlánc periodikus szerkezet, amelyik aminosavegységenként két egyes kötést tartalmaz, amelyek körül a lánc szabadon elfordulhat. Valójában ez a forgás mégsem teljesen szabad, hiszen az aminosav-oldalláncok nem ütközhetnek egymással, ill. a főlánc atomjaival. Tételezzük fel, hogy a térbeli átfedések miatt ezek a változtatható kötésszögek átlagosan csak két értéket vehetnek fel (ezzel erősen alulbecsültük a lehetőségeket). Így minden egyes aminosav csupán a főlánc szerkezeti formáit (konformációit) tekintve 4-féle állapotot vehet fel, a teljes polipeptidlánc konformációinak száma pedig:
N = 4 . 4 . 4 . ... . 4 = 4300 ≈ 10180 db
Ha ehhez még hozzávesszük, hogy az aminosav-oldalláncok is – sokszor több kötés körül is – szabad forgást végezhetnek, érzékelhetjük, hogy egy fehérje lehetséges konformációinak száma rendkívül nagy.
Számos kísérlet utal arra, hogy egy fehérje natív szerkezete az energetikailag legkedvezőbb szerkezet. De vajon hogyan lehet ennyi lehetséges konformáció közül megtalálni a legkedvezőbbet? Hiszen ha egyetlen másodperc 1000 milliárd konformáció végigpróbálgatására elegendő, akkor a 10180 lehetséges konformáció kipróbálásához 10168 másodpercre lenne szükség, ami messze meghaladja az Univerzum 15 milliárd éves életkorát. A lehetséges konformációk gigantikus száma miatt a legkedvezőbb energiájú térszerkezet megtalálása még legmodernebb szuperszámítógépeinkkel is egyelőre reménytelen feladat. Pedig új fehérjék tervezéséhez, a fehérjékben rejlő lehetőségek kihasználásához ennek a problémának a megoldása elengedhetetlen. Biztatást jelenthet számunkra, hogy egy mesterségesen kitekert fehérje általában néhány másodperc alatt képes helyesen feltekeredni, s újra felvenni működőképes állapotát. Egy fehérjemolekula számára sincs elég idő ahhoz, hogy kipróbálja valamennyi lehetséges állapotát. Meg kell még ismernünk tehát azokat az alapvető törvényszerűségeket, amelyek az összes térszerkezeti állapot végigjárása nélkül is lehetővé teszik a legkedvezőbb energiájú szerkezet azonosítását.
Meglévő tapasztalataink alapján azért egyszerűbb feltekeredési mintázatokat már ma is létre tudunk hozni, ezeket primitív funkciókkal fel tudjuk ruházni, azonban mesterséges fehérjéink tulajdonságai messze elmaradnak természetes társaikétól. Ennek legfőbb oka az, hogy a fehérjék működésében meghatározó szereppel bíró dinamikai tulajdonságok tervszerű kialakítására egyelőre esély sincsen.
A fehérje alapú nanotechnológia megvalósításának mai tudásunkat messze meghaladó következő lépcsőfokát jelentené a mesterséges fehérjékből álló önszerveződő komplex rendszerek, molekuláris gépezetek létrehozása. Ilyen jellegű próbálkozások ez idáig még nem is történtek. S végezetül távlati célként fogalmazhatjuk meg a riboszómákhoz hasonlóan működő programvezérelt molekuláris összeszerelő rendszerek megalkotását.
Alkalmazások
Mit várhatunk a bio-nanotechnológiától? Mennyiben javíthat életünkön? Egyelőre a fehérje alapú nanotechnológia eredményeivel mindennapi életünkben ritkán találkozhatunk. A módosított fehérjék jelenlegi nanotechnológiai alkalmazásai alapvetően két csoportba sorolhatók: egyrészt önszerveződő képességüket kiaknázva kiválóan alkalmazhatók molekuláris objektumok építésére, másrészt specifikus molekulafelismerő képességüket kihasználva bioszenzorok alapelemeiként érzékelési feladatokra használhatjuk őket.
Konkrét nanotechnológiai alkalmazásként tekintsük át, hogy miként hozhatunk létre rendezett kvantumpötty mintázatokat módosított fehérjék segítségével. A kvantumpötty néhány nanométeres átmérőjű parányi fémsziget. A kvantummechanika szerint egy parányi fémpötty elektromos és optikai tulajdonságait (pl. színét, gerjeszthetőségét) elsősorban mérete, nem pedig anyagi minősége határozza meg. A méret precíz kontrollja révén tehát az elektromos és optikai tulajdonságok is precízen szabályozhatók. Egy-egy ilyen fémszigetecske pontosan megtervezett elektromos tulajdonságokkal rendelkező memóriaelemként funkcionálhat, amely akár egyetlen elektronnal vezérelhető. Kémiai úton rendkívül nehéz atomi léptékben azonos méretű kvantumpöttyöket előállítani, fehérjék segítségével azonban egészen egyszerűen megvalósítható. A vérben található ferritin fehérje a vasatomok megkötését és tárolását végzi. 24 azonos alegységből áll, amelyek rendelkeznek az önszerveződés képességével, s spontán módon egy üreges, labdaszerű képződményt formálnak (3/a ábra). A ferritin fémkötési tulajdonságainak génsebészeti módosításával különféle fémek specifikus felismerésére és megkötésére képes ferritin variánsokat állíthatunk elő, pl. olyanokat, amelyek arany vagy éppen nikkel megkötésére képesek. A ferritingömböcskék az alegységek közötti pórusokon keresztül oldatban begyűjtik a megfelelő fémionokat, s a belsejükben egy szigorúan meghatározott méretű fémgömb alakul ki. A fehérjék kristályosíthatóságát kihasználva a fémmagot tartalmazó ferritin molekulákból alkalmas felületen rendezett mintázatokat, ún. kétdimenziós kristályokat hozhatunk létre (3/b ábra). Végezetül a fehérjeburkot eltávolítva (pl. UV- vagy hőkezeléssel) rendezett kvantumpötty mintázathoz jutunk.
3. ábra A ferritin fehérje segítségével előállított rendezett kvantumpötty mintázat.
(a) A vérben található ferritin fehérje a vasatomok megkötését és tárolását végzi. 24 azonos, önszerveződésre képes alegységből áll, amelyek spontán módon egy üreges, labdaszerű képződményt formálnak. A ferritin fémkötési tulajdonságainak génsebészetileg módosíthatók. A ferritin gömböcskék az alegységek közötti pórusokon keresztül oldatban begyűjtik a megfelelő fémionokat, s a belsejükben egy szigorúan meghatározott méretű fémgömb alakul ki.
Hogyan készíthetünk fehérjéken alapuló bioszenzorokat, amelyek szinte tetszőleges célmolekulát képesek felismerni? A korábbiakban láttuk már, hogy a magasabb rendűek immunrendszerében meghatározó szerepet játszó immunglobulin (IgG) fehérjék akár több millióféle idegen molekulát képesek megbízhatóan felismerni. Valójában a természet nagyszámú IgG variánst generál, amelyek abban különböznek egymástól, hogy a szervezetbe kerülő idegen anyagok felismerésében és megkötésében szerepet játszó felületi hurokrégiók aminosavszekvenciája eltér egymástól, ezáltal különféle kötőfelületek jönnek létre. Az immunglobulinok esetében megfigyelt alapelveket alkalmazva más, eredetileg receptor tulajdonságokkal nem rendelkező fehérjék felületén is kialakíthatunk adott célmolekulára specifikus kötőhelyeket. Így pl. Skerra és munkatársai a lipocalin fehérje felületi hurokrégióinak aminosavszekvenciáit génsebészeti módszerekkel véletlenszerűen variálva nagyszámú mutánst hoztak létre (4/a ábra), majd ezek közül megfelelő szelekciós eljárások alkalmazásával kiválasztották az adott célmolekula erős és specifikus megkötésére képes módosulatokat. Az így előállított mesterséges receptorok bioszenzorok alapeleméül szolgálhatnak, amelyek parányi mennyiségű mintából képesek eldönteni egy-egy komponens jelenlétét. Pl. az ún. rezgőnyelves bioszenzorokban receptorainkat egy nagyfrekvenciával rezgetett parányi szilíciumlapkára rögzítjük (4/b ábra). Ha a lapka felett átáramoltatott mintában jelen van a keresett komponens, akkor azt a lapka felületén lévő receptorok megkötik, ami tömegnövekedéssel és a rezgési frekvencia megváltozásával jár. Mindez a lapkára bocsátott lézerfény eltérülésének megváltozása révén könnyen detektálható.
4. ábra Rezgőnyelves bioszenzor
(a) A lipocalin fehérje felületi hurokrégióinak aminosavszekvenciáit variálva nagyszámú mutáns hozható létre, amelyek közül megfelelő szelekciós eljárások alkalmazásával kiválaszthatók egy adott célmolekula erős és specifikus megkötésére képes módosulatok.
(b) Az így előállított mesterséges receptorokat nagyfrekvenciával rezgetett parányi sziliciumlapkára rögzítve bioszenzorokat állíthatunk elő. Ha a lapka felett átáramoltatott mintában jelen van a keresett komponens, akkor azt a lapka felületén lévő receptorok megkötik, ami a rezgési frekvencia megváltozásával jár.
De a bio-nanotechnológiától nemcsak a fentiekben bemutatott speciális alkalmazások várhatók. Életünkre talán legnagyobb hatással a bio-nanotechnológia gyógyászati alkalmazása lehet. Az élő szervezetek alulról építkező, molekuláris nanotechnológiát használó rendszerek, szemben a klaszszikus orvostudomány hagyományos technológiákon alapuló megközelítési módjával. A ma alkalmazott módszerek alkalmatlansága, a molekuláris megközelítés fontossága számos esetben magától értetődő. A műtőasztalon fekvő rákos beteg határozottan érzi, hogy valami nagyon nem helyénvaló dolog történik vele. A daganat valódi oka sokszor egy apró hiba a DNS-ben, amit ha kijavítanánk, a beteg meggyógyulna. Olyan parányi molekuláris gépezeteket kellene készítenünk, amelyeket a vérbe juttatva azok azonosítanák a beteg sejteket, s hozzájuk tapadva bejuttatnák azokat a fehérjekomponenseket, amelyek kijavítanák a problémát okozó DNS-hibát. És minden rendbe jön a test felnyitása nélkül, a beteg a beavatkozás közben észre sem vesz semmit. Néhány rákfajta esetében ilyen kis gépezetek egyszerűbb változatai már klinikai kipróbálás alatt állnak. Nem is olyan távoli az az idő, amikor az ehhez hasonló gyógymódok általánossá válnak.
A várakozások szerint a XXI. század a molekuláris biológia és a nanotechnológia évszázada lesz. Egyre nyilvánvalóbb, hogy a fehérjék mindkét területen meghatározó szerepet játszanak majd. Kérdés, mennyire sikerül ellesnünk az élő szervezetektől a fehérje alapú molekuláris gépezetek szerveződési elveit, megfejteni működésük mechanizmusát, hogy a magunk kedve szerint építhessünk talán még a természetben megfigyelhetőknél is lenyűgözőbb képességű nanoméretű eszközöket.






Friss hozzászólások
5 év 39 hét
8 év 12 hét
8 év 16 hét
8 év 16 hét
8 év 18 hét
8 év 18 hét
8 év 18 hét
8 év 20 hét
8 év 21 hét
8 év 21 hét