Szubjektív visszapillantás
A hatvanas évek második felében egy esztendőt Angliában töltöttem vendégkutatóként az Oxfordi Egyetem biokémiai tanszékén. Nagy dolog volt ez akkor, hiszen nyugatra kevesen utazhattak, azok is csak kellő indokkal. Friss kandidátusként mintegy jutalmul kaptam e „kimenőt”, amely egy évre, pontosan 365 napra szólt. Ha akár egyetlen nappal túllépem – figyelmeztettek az illetékesek – az már az illegális külföldön tartózkodásra kiszabott szankciókkal jár. Igyekeznem kellett mindent egy szűk évbe belezsúfolni. Manapság a friss posztdokok minimum 2-3 évre mennek külhonba a kísérletes élettudományok területén, mert legalább ennyi idő kell az eredményességhez. Ebbe beletartozik a beszélt angol nyelv megfelelő elsajátítása is. Oxford e tekintetben különösen inspirálónak ígérkezett. Ám hamar rájöttem, hogy ha egész nap – estékbe nyúlóan – egymagam szöszmötölök a laborban, csak a kávé- és teaszünetek alatt meglepően kevés nyelvtudás ragad az emberre. Elkezdtem hát előadásokra járni, hogy legalább a megértésben fejlődjek. Különösen alkalmasak voltak azok az este fél 8-kor kezdődő, meghívott előadók által tartott nagyelőadások, melyek egy-egy izgalmas új terület fejleményeiről szóltak. A legtöbbet már elfelejtettem, egy azonban ma is elevenen él emlékezetemben. Az előadás címe Memory molecules, vagyis Memória-molekulák volt. A nálam alig idősebb előadó a Londoni Egyetemről ruccant át, dallamos public school angolt intonált, és nem állított kevesebbet, mint hogy az emlékezet (memória) molekuláris alapjait felfedezték. A hallgatóság lélegzetvisszafojtva figyelt, mint nagy bejelentések fültanúihoz illik. Az előadás végén az ifjú levezető elnöknő elfogódott hangon köszönte meg a nagyszerű (superb) előadást. A fáradt előadó bágyadt, elhárító félmosollyal nyugtázta ezt. Brit fegyelmezettsége nem engedte lelkesedni, de látszott, tisztában van vele, mit nyújtott ő nekünk akkor este.
A memória-transzfer csalfa vonzásában
A memória mibenléte, az emléknyom (engram) kémiai természete akkor már évtizedek óta izgatta a biokémikusokat. Több-kevesebb összhang volt abban, hogy az emléknyom az idegsejtekkel (neuronokkal) függ össze, és nem elektromos természetű, hanem a (bio)kémia eszközeivel jellemezhető. Számos nagy laboratórium végzett heroikus, évekig tartó kísérletsorozatokat, két kérdés körül: 1. az állat (egér, patkány) agyában milyen változások jönnek létre a tanulás során, illetve 2. milyen beavatkozások képesek a memória kialakulását meggátolni vagy esetleg fokozni. Rengeteg részeredmény született, de érdemleges megoldás egy sem. A bökkenő ott volt, hogy a kutatók nem tudták, mit is keressenek, illetve miről fognak ráismerni, ha esetleg megtalálták.
Fordulat következett be, amikor egyszerűbb állatokkal, nevezetesen örvényférgekkel (planáriákkal) kezdtek kísérletezni. A planáriák ösztönösen fénykerülők, de megfelelő ingertársításokkal (pl. sötéttel – enyhe áramütéssel) ez megfordítható: megtanulják, hogy a sötét kellemetlen, a fény viszont nem. Amikor választás elé kerülnek, a fény felé másznak. Ez valódi tanulás, hiszen környezeti ingerek hatására bekövetkező adaptív magatartásváltozás.
A kutatók úgy gondolták, a tanult állat agyában képződött valamilyen anyag, ami a sötét elkerülését „kódolta”. Kivonatot készítettek a tanult állatok agyából, amit naiv állatokba vittek. Többféle átviteli módszerrel próbálkoztak; az agyba való injektálástól egészen odáig, hogy a tanult állatokat feletették a naivakkal (kannibalizmus). Nagy örömükre a kezelt naiv állatokból több sötétségkerülő lett! A kivonat frakcionálásával végül odáig jutottak, hogy az aktív anyag egy fehérje vagy rövid peptid, esetleg RNS-darab. A leghatásosabb peptidet elnevezték scotophobinnak („sötétségkerülő”).
Az a gondolat, hogy a szerzett (tanult) információ egy biopolimer (peptid, fehérje, nukleinsav) építőköveinek sorrendjében kódolódjék, akkoriban igen logikusnak látszott. Hiszen 1953-ban írta le Watson és Crick a DNS szerkezetét, és a 60-as évek elejére esik a genetikai kód megfejtése (azaz annak kiderítése, hogy a DNS-ben, illetve az arról átírt RNS-ben három bázis sorrendje [tripletje] jelent egy aminosavat). Ha az öröklött információ (a génállomány) ilyen alapon tárolódik, akkor hasonló mechanizmussal tárolódhat a szerzett információ, vagyis a memória. A párhuzam lehetősége megejtő volt. De, sajnos, nem volt igaz. Laboratóriumokban végzett ellenőrző vizsgálatok egyértelműen igazolták, hogy a látszólag pozitív memóriatranszfer-eredmények módszertani hibákból eredtek.
Az írás elején felvillantott oxfordi előadó a memóriatranszfer-kutatásokról szólt, persze a téma felszálló ágában. Azóta is aktív, könyveket ír az agy működéséről, többet lefordítottak magyarra is. Ezekben a memóriatranszfer-kísérleteket tudományos zsákutcaként tárgyalja. Megnevezi az irányzat fő zászlóvivőit, saját nevét nem említi. Hallgassuk el mi is.
Az elemi memória
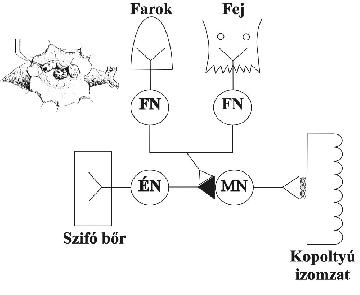
A memóriafolyamatok molekuláris alapjainak érdemi vizsgálata attól számítható, amikor alsóbbrendű állatok jól definiált reflexíveinek módosulásait kezdték vizsgálni. A reflexíveket neuronok alkotják: a legegyszerűbb mindössze két idegsejtből – egy érző neuronból (ÉN) és egy mozgató neuronból (MN) – áll, találkozási helyük, ahol az ingerület áttevődik, a szinapszis. Az áttevődés úgy történik, hogy az ÉN idegvégződéséből átvivő molekulák szabadulnak fel, amelyek az MN határoló membránjába ágyazott receptormolekulákon megkötődve átviszik az ingerületet a következő sejtre, példánkban az MN-re. A szinapszis állapotától függ, hogy a beérkező jel változatlanul, gyengítve vagy felerősödve megy tovább. A szinapszis tehát olyan igen/nem kapu, mely számos köztes állapotot ismer. Az átvitel erősségének változtathatóságát nevezik szinaptikus plaszticitásnak (képlékenységnek). Ennek iránya és mértéke az elektrofiziológia módszereivel pontosan mérhető, ha elektródákat szúrunk a megfelelő idegképletekbe.
Eric Kandel és munkatársai (Albert Einstein Institute, USA) egy tengeri csiga, az Aplysia californica kopoltyú-összehúzási reflexét tanulmányozták. Ha az állat szifó nevű testrészét enyhén megérintették, a terebélyes kopoltyú kicsire zsugorodott. Ha ezt az ingerlést sokszor ismételték, az összehúzódás elmaradt: hozzászokás (habituáció) állt be. Ha viszont az állat fejére vagy farkára kellemetlen ingert mértek, az utána alkalmazott enyhe szifó-ingerlés viharos kopoltyú-összehúzódást eredményezett: érzékenyítés (szenzitizáció vagy facilitáció) következett be.
Kandelék azt a kérdést tették fel, hogy milyen sejtbiológiai-biokémiai folyamatok idézik elő az érzékenyítést. A tengeri csiga mint kísérleti állat azért is volt szerencsés választás, mert a puhatestűek neuronjai igen nagyok, sokkal nagyobbak, mint az emberé vagy a patkányé. Ez tette lehetővé, hogy az állat idegdúcában a neuronok pontos kapcsolási rajzát elkészítsék: meghatározták, melyek az érző, mozgató, szenzitizáló (facilitáló) neuronok (FN). A neuronok nagysága folytán mindegyiket lehetett egyedileg vizsgálni, nemcsak ingerlésre és elvezetésre, hanem injektálásra is. Az óriásneuronok mintegy mini kémcsöveknek voltak tekinthetők: amit belefecskendeztek, az abban a sejtben volt, és nem másutt. Az 1. ábra mutatja az Aplysia kopoltyú-összehúzási reflexében szereplő sejtek és összeköttetéseik egyszerűsített sémáját. Habituációkor az ÉN végződéséből egyre kevesebb ingerátvivő molekula szabadul fel, szenzitizációnál viszont egyre több. Az ábrán látható, hogy a fej-farok felől érkező facilitáló inger az ÉN végződéséhez fut (preszinaptikusan), és abban indukál valamit, ami az ÉN-ből fokozott átvivő kiürülést eredményez. Ez a valami a következő (2. ábra): az FN végkészülékéből szerotonin szabadul fel, amely megkötődik az ÉN végződésén lévő receptormolekulákon. A receptor továbbítja e jelet a sejt belsejébe, a membrán belső felszínéhez tapadt G-fehérjékhez, amelyek viszont a sejtben lévő különböző enzimeket (az élő specifikus katalizátorait) aktiválják. Az egyik célenzim az adenilát cikláz, amely a sejtek univerzális energiatároló vegyületéről, az ATP-ről két foszfátcsoport lehasításával ciklikus AMP-t (cAMP) csinál. A cAMP fontos szabályozó molekula, mert aktiválni tud egy másik enzimet, a cAMP-függő protein kinázt (PKA). A PKA, ATP jelenlétében, fehérjék egyes aminosav-oldalláncaihoz foszfátcsoportot (-P) köt, amely gyökeresen megváltoztatja e célfehérjék működését. Az ÉN végződésben, például, a sejthártyába ágyazott K+-ionokat szállító csatornafehérjéket módosítja (foszforilálja), ennek hatására a csatorna részlegesen bezáródik. Ez a változás elég ahhoz, hogy a reflexíven végigfutó ingerületi hullám a rendesnél hosszabb ideig tartsa nyitva a kalciumcsatornákat, ekkor a sejtvégződésbe a sejten kívüli térből sok kalcium jut be. Nincs módunk részletezni, de a megemelkedett kalciumszint felerősíti az ingerületátvivő molekula MN felé való kiáramlását. Ha több a jelátvivő, erősebb az MN ingereltsége, tartósabb a kopoltyúizmok összehúzódása – mindez megváltozott magatartás. Ezen – első olvasásra tán bonyolultnak tűnő, ám mégis viszonylag egyszerű – biokémiai reakciósor hozza létre az elemi memóriát.
Mi tekinthető a fenti folyamatban „emléknyomnak”? Leegyszerűsítve a választ: a káliumcsatorna foszforiláltsága. Ha a P-csoportot lehasító protein foszfatáz (PP) enzimek hatására ez megszűnik, az eredeti magatartás visszaáll. Talán kiábrándító, hogy a sokat keresett, misztifikált emléknyom mindössze egy foszforsav – hasonló ahhoz, ami a hajdan népszerű Trisó súrolószerben volt. Ne feledjük azonban, hogy a polcon tartott foszforsav nem emléknyom. Ezzé csak akkor nemesedik, ha egy idegsejt-kapcsolat megfelelő részletében egy membrán-kálium-csatorna fehérjéjébe a fent vázolt módon beépül. Ha ezt a sejtes szerkezetet durván elroncsoljuk, építőköveire esik szét, és másodlagos folyamatok az alkatrészeket felismerhetetlenné szabdalják. Az „emléknyom” voltaképpen az a sejtes-molekuláris elrendezettség, amelyet ilyenkor óhatatlanul megsemmisítünk. Ha egy vitrin tartalmát darabokra zúznánk, majd a törmeléket beöntenénk egy ép vitrinbe, a korábbi biedermeier hangulatot hiába keresnénk.
Tartós emlékezet
Saját tapasztalatunkból tudjuk, hogy a memória időskálája igen széles: van rövid távú memória (RTM) és hosszú távú memória (HTM), melyek abszolút tartama a fajtól függ. Embernél pl. az RTM tárol egy új telefonszámot, néhány percig, a HTM-ben viszont olyan adatok vannak elraktározva (nevünk, születési adataink stb.), melyekre akár életünk végéig emlékezünk. Ha mégis elfelejtjük ezeket, az nem normális felejtés, hanem kóros agyi folyamatok következménye. (Zárójelben említem, hogy az RTM és HTM megjelölés némileg önkényes, tartamuk konvención alapul. Egyes kutatók további memóriafázisokat is megkülönböztetnek, pl. a középtávú memóriát (KTM). Ezek részletezése itt nem célunk.)
Az Aplysia fent ismertetett reflexszenzitizációja az RTM tartományába esik. Kandel és munkatársai ki tudtak alakítani HTM-nek minősíthető módosulást a csiga reflexívén, ha a facilitáló pályákat egy időben ingerelték az ÉN-nel, és ezt sokszor, 10-15 alkalommal megismételték, közbeiktatott pihenőkkel. Tökéletes párhuzamba állítható ez saját tapasztalatainkkal: ha valamit tartósan meg akarunk jegyezni, sokszor el kell ismételnünk, közbeiktatott pihenőkkel. A csigánál azt a lényeges megfigyelést tették, hogy a HTM kialakulását meg lehet akadályozni, ha az érintett agydúcba fehérjeszintézis-gátlókat juttatnak. Ezek olyan kis molekulák, melyek a fehérjék szintézisében részt vevő enzimet gátolják. Ennek nyomán fogalmazódott meg az az empirikus tétel, hogy míg az RTM a meglévő fehérjekészlet módosításával jön létre, addig a HTM-hez újonnan szintetizált fehérjékre is szükség van.
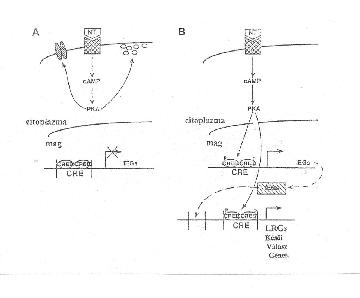
Mire kellenek a friss fehérjemolekulák, és melyek ezek? Ennek felderítésén világszerte dolgoznak. Mivel a HTM-ben az érintett szinapszisok megerősödnek/átépülnek, szükség van nagyobb mennyiségű „kommersz” építőanyagra. Másik fontos kérdés, hogy miként megy át az RTM HTM-be. Az Aplysia esetében láthattuk, hogy az RTM kialakulása a cAMP felszaporodásával jár. Bizonyos szint felett a cAMP bejut a sejtmagba, ahol a gének (DNS) átírása folyik, és a magi PKA-t aktiválja, mely itt a CREB fehérjét foszforilálja. A CREB foszforilált alakja a sejtmagban génkifejeződést indít el, vagyis új fehérjék szintetizálódnak. Ha a CREB-nek egy módosított változatát juttatják be a magba, mely permanensen aktív, a HTM kialakulása jelentősen felgyorsul. Eric Kandel döntően a csigák memóriamechanizmusainak felfedezéséért kapott Nobel-díjat 2000-ben.
Muslicák
Az ecetmuslicát (Drosophila melanogaster) mindenki ismeri. Ha nyár végén érett gyümölcsöt vagy aromás italt fogyasztunk, ezek az apró, nem várt vendégek azonnal megjelennek, szinte a semmiből. Kiváló szaglásuk irányítja őket a táplálékforráshoz. Ártalmatlanok, nem csípnek, betegséget sem terjesztenek, mégsem szeretjük őket, mert beleesnek ételbe-italba vagy akár a szemünkbe is.
Kevesen tudják, hogy ezen apró kellemetlenségek eltörpülnek azon szolgálatok mellett, melyeket e kis élőlény az emberiségnek tett. Thomas Hunt Morgan és munkatársai a múlt század elején ezeken az állatokon dolgozták ki az örökléstan (genetika) alapjait, amelyek fejlettebb állatokra – és az emberre – is érvényesek. A Drosophila ma is az egyik legalkalmasabb faj számos életfolyamat tanulmányozására. Ennek oka, hogy a muslicában igen könnyen lehet célzottan megváltoztatni a génállományt: hiánymutánsokat vagy épp ellenkezőleg, bizonyos aktív anyagokat (pl. egy enzimet) túltermelő törzseket lehet létrehozni, majd ezen beavatkozások élettani következményeit analizálni. Ha pl. az a kérdés, hogy mely gének (vagyis azok fehérjetermékei) vesznek részt egy tanulási-memóriafolyamatban, akkor ezt meg lehet kérdezni a muslicáktól, feltéve hogy egyáltalán tudnak tanulni, és mi tudjuk mérni a tanulási teljesítményt.
A muslicának mint kísérleti állatnak van még egy gyakorlati előnye: mivel nem gerinces állat, nem védik az egyre szigorúbb állatvédelmi törvények. De azért ne sajnáljuk őket, hogy egész életüket a zöld mezők helyett egy sivár fiolába vagy cumisüvegbe zárva töltik. Mint vezető etológusunk egyszer mondta: tizedmilligrammos aggyal nem lehet szomorkodni.
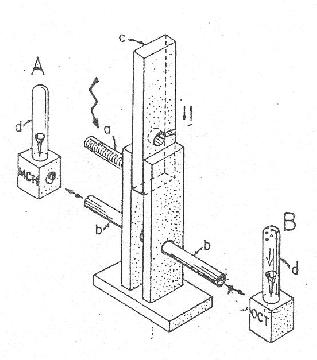
Seymour Benzer (California Institute of Technology, USA) hitt a muslica tanulási képességében (sokan nem hittek!), és munkatársaival szerkesztett egy tanító kamrát feltevései igazolására (3. ábra). A tanítás során a muslica A és B szagnak van felváltva kitéve; az A szaghoz társul egy kellemetlen inger (enyhe áramütés), a B szaghoz viszont nem. Pontos időzítéssel a szagtársításokat háromszor ismételték, majd az állatokat (egyszerre 80-100 muslica is tesztelhető) választási helyzetbe hozták: két oldalról áramlik az A, ill. a B szag. A normál (vad típusú) muslicák zöme megtanulja, hogy az A szag veszélyes, és a B szagú csőbe fog vándorolni. A számított tanulási index kb. 0,95 (az elméleti maximum, a tökéletes tanulás 1,0), vagyis a szag-áramütési teszt alapján a muslica kimondottan jó tanulónak bizonyul.
Buta és okos mutánsok
Benzerék ezután előállítottak mintegy ezer mutáns törzset: a 70-es évek technikai színvonalán ez úgy történt, hogy hím muslicákkal egy speciális vegyszert etettek, amely a DNS-ben változásokat (mutációkat) idézett elő. Ügyeltek arra, hogy egy hímben csak egyféle változás legyen. Ezeket aztán „kiházasították”, minden mutáns hím kapott sok szűz feleséget: így olyan törzs (vonal) jött létre, amelynek minden tagja hordozta a mutációt valamelyik kromoszómáján. (A kromoszóma DNS-ből és fehérjékből álló képlet, a gének hordozója; a muslicának négy pár kromoszómája van.) A törzseket ezután megvizsgálták a fent vázolt tanulási tesztben. Sok száz törzset néztek át, mire találtak egyet, amelynek tanulási indexe közel zérus volt. Ezt még sok szempontból megvizsgálták, nem a szaglása romlott-e, vagy nem érzi az áramütést, vagy csökkent a mozgékonysága, stb. Az ellenőrző méréseken azonban a törzs nem akadt fenn: a kifejlett állat csak abban különbözött a vad típustól, hogy buta volt. A törzset elnevezték dunce-nak (dunce = buta, ostoba; Dunce Scotus középkori teológus nevéből eredő angol szó).
A dunce-nak több altípusát izolálták, melyekben a gén más-más helyen sérült. A tanulástól eltelt idő függvényében mérve a tanulási indexet a vad típusú Canton S törzsnél és két dunce törzsnél kiderült, hogy a tanítást közvetlenül követően a dunce-ban is van kimutatható tanultság, de az meredeken csökken: a dunce gyorsan felejt (4. ábra). Ennek alapján nem tanulás-, inkább memóriamutánsnak tekinthető.
A nagy kérdés persze az volt, hogy milyen fehérjét kódol a dunce gén. Független kutatások szerencsés találkozása révén kiderült, hogy a dunce törzsben egy enzim, a II típusú cAMP-foszfodiészteráz (PDE II) sérül; ez az enzim hasítja a cAMP-t, amelyről az Aplysia tanulási modelljénél már szóltunk. Röviddel a dunce mutáns felfedezése után találtak egy másik memóriadeficites mutánst, a rutabagát (répafajta). Erről kiderítették, hogy a sérült gén egy adenilát ciklázt kódol, vagyis azt az enzimet, amelyik a sejtekben a cAMP-t előállítja. Az 5. ábra sémája illusztrálja, hogy a cAMP-anyagcserét közvetlenül meghatározó két enzim bármelyikének sérülése tanulásromláshoz vezet. A kémiai reakciók törvényei szerint, ha egy kétlépéses reakció első lépését gátoljuk, a köztes termék (itt a cAMP) szintje csökken. Ha a második lépés gátlódik, a cAMP-szint megemelkedik. Valóban, a kísérletek ezt mutatták: a dunce-ban magas, a rutabagában alacsony a cAMP-szint. A kutatók ekkor összehozták a két mutációt egy törzsben (muslicánál ez viszonylag egyszerű), és azt várták, hogy így a normál cAMP-szint helyreáll. Ez a várakozásuk be is jött. Ám megmérték a kettős mutáns tanulási teljesítményét, és az bizony nem javult, sőt. Mi ebből a tanulság? Az, hogy nem a cAMP abszolút szintje, hanem a cAMP anyagcsere-dinamikája (gyors változása) kell a tanuláshoz.
A Drosophilánál is ki tudtak alakítani HTM-et ismételt, időben elkülönülő tanulási ciklusokkal (a muslica egy-két hónapig él, a HTM tartama kb. 7 nap). Az Aplysiánál leírt CREB fehérje homológját megtalálták a muslicában, itt is két alakban: az egyik elősegítette a HTM-hez vezető génkifejeződést, a másik gátolta. A pozitív hatású alakot túltermeltetve az állat idegdúcában, mondhatni, „zseniális” muslicákat kaptak. A HTM egy tanulási ciklus alatt alakult ki bennük, amihez tíz ciklusra van szükség a vad típusnál. Ez az eredmény mérföldkő volt a Drosophila-memóriakutatásban, mert a korábban talált memóriamutánsok (dunce, rutabaga és sok más) mind gyengébben tanultak, mint a vad típus. És ezt a kutatók úgy értelmezték, hogy a törzsfejlődés során a tanulás biokémiai mechanizmusa is optimalizálódott, ennél jobbat nem lehet csinálni. Az eredmény alapján láthatjuk, hogy bizony lehet. Az ebben rejlő lehetőségekre alább még kitérünk.
Egerek és emberek
De előbb hadd fűzzek egy megjegyzést a Drosophila-kísérletekhez. Ha egy értelmiségiekből álló társaságban felmerül, hogy ki mivel foglalkozik, és én – némi egyszerűsítéssel – azt válaszolom, hogy a muslicák memóriájával, bejelentésem várakozásteli derültséget kelt. Azt hiszik, most valami móka következik, hiszen maga a muslica (vagy muslinca) szó a magyar fület csiklandozza; míg az angol fruit fly vagy különösen a latin Drosophila melanogaster már komolyan hangzik. Amikor erősködöm, hogy ez nem vicc, fejcsóválva jegyzik meg, hogy persze, az ország jelen állapotában ez kell a magyarnak. (A „jelen” itt nem a mára, hanem az elmúlt kb. három évtizedben bármikorra vonatkozhat, a jelenség tökéletesen rendszersemleges.) Az említett vélemény híven tükrözi a tudományos alapkutatás jelentőségének szomorú meg nem értését. A kutató számára, aki az életfolyamatok molekuláris alapjait akarja megismerni, a muslica nagyon is előnyös modellszervezet; a fehérjemolekulák szerkezetében a muslica és az ember alig különböznek egymástól, bár külsőleg tényleg nem hasonlítanak. Az emlősállatok (egér, patkány) valóban közelebb állnak az emberhez testfelépítésük, agyszerkezetük tekintetében, de tudja-e a T. Olvasó, hogy mibe kerül egy kísérleti fehér patkány, és mennyibe egy vagy, mondjuk, száz muslica? Az árkülönbség sok nagyságrendnyi. Egy magunkfajta forrásszegény országban a muslicakutatásoknak jóval nagyobb teret kellene kapniuk. Ezt az igazságot tőlünk nyugatra, ahol pedig forrás is van, már régen felismerték. Ezért kapott a német Christiane Nüsslein-Volhard (Tübingen) és az amerikai Eric Wieschaus (Princeton) Nobel-díjat 1995-ben, miután felismerték a korai embrionális fejlődés molekuláris alapjait a Drosophilában.
Memóriakutatások természetesen emlősállatokon (egér, patkány stb.) is folynak, és az ember kognitív és emlékezőképességét is vizsgálják különböző módszerekkel. A bonyolult ideghálózatok teljesítményét nem lehet pár fehérjemolekula tulajdonsága alapján megmagyarázni, de ez nem jelenti azt, hogy az elemi molekuláris folyamatok a hálózatokban ne érvényesülnének. Az ideghálózatok vizsgálata összefonódott a kibernetikával, a számítógép-fejlesztés felhasználja azokat a kapcsolási-felismerési elveket, melyeket az agy vizsgálatánál fedeztek fel.
A gerinctelenekben talált és a HTM-ben szerepet játszó CREB fehérjéket megtalálták egérben, patkányban és az emberben is. Ezek a fehérjék az emlősállatokban szintén hozzájárultak a HTM kialakulásához (6. ábra). Eric Kandel, immár a Nobel-díj birtokában, alapított egy biotechnológiai céget, ahol memóriajavító szerek kifejlesztésén dolgoznak. Azt persze sűrű homály fedi, hogy ezeknek mi a képlete, de alighanem az általuk felismert CREB hatását elősegítő drogokról lehet szó. Már kis javulás a memóriafolyamatokban óriási jelentőségű volna, hiszen az időskori szenilitás különböző formái a társadalomra – különösen a fejlett országokban – irdatlan és egyre növekvő anyagi/erkölcsi terheket rónak.
Az élő emberi aggyal molekuláris szintű kísérleteket végezni tilos. Szerencsénkre a „piszkos munkát” elvégezhetjük állatokon (muslicán, csigán, egéren, patkányon), hiszen a törzsfejlődés révén közelebbi-távolabbi rokonaik vagyunk, és ez fehérjemolekuláinkon sokkal jobban látszik, mint külső megjelenésünkön.
E dolgozatban a memória molekuláris mechanizmusaiból csak néhányat tárgyaltam: azokat, melyek eddig a legtöbb figyelmet kapták. Ezeknek is csak néhány mozzanatát, ami koherens képet adott. Az emléknyom azonban más biokémiai reakciók útján, más fehérjék, enzimek bevonásával is rögzülhet. Úgy tűnik, a lehetséges utakban van bizonyos redundancia, aminek a biológiai előnyei nyilvánvalók. Tárgyalásuk, mérlegelésük szakfolyóiratok feladata.
Cikkem elején érzékeltettem, miért volt vonzó a memóriatranszfer-hipotézis, és azt is, hogy miért lehetetlen. A tudásért az egyénnek kell megdolgoznia, akár állat, akár ember; készen nem kapható. A kipróbálás alatt álló memóriajavító szerek nem egy konkrét információt adnak át, hanem a tanulás és memorizálás folyamatát tehetik könnyebbé. Új keletű kísérleti megfigyelés, hogy idegsejtjeink az évek során nemcsak pusztulnak, hanem bizonyos ingerekre újonnan is keletkezhetnek: ilyen inger a tanulás. Ha tehát nem kívánunk elbutulni, állandóan eddzük szellemünket, járassuk a tanulás/memória reakciópályáit. Régi bölcsesség ez – „jó pap holtig tanul” –, és igen biztató, hogy a modern vizsgálatok ezt alátámasztják.
1. ábra. Az Aplysia kopoltyú-reflexívének vázlata
Balra fent: Az Aplysia képe. Az állat 20-25 cm hosszú, a képen a kopoltyúfedők szét vannak hajtva, középen a teljesen összehúzott kopoltyú. A szifót az üvegcsőből kiáramló (tenger-)vízsugárral ingerlik.
Fő ábra: A szifótól jövő ingerlés az érző neuron (ÉN) végződésén átcsatolódik a mozgató neuronra (MN), mely az ingerületet a kopoltyúizmokhoz vezeti, mire ezek összehúzódnak. Ha az állat fejére vagy farkára kellemetlen ingert mérünk, a facilitáló neuron (FN) az ingerületet az ÉN végződéséhez vezeti (sötét háromszög). Ami itt történik, látható a 2. ábrán.
2. ábra. Az Aplysia kopoltyúreflex-szenzitizációjának mechanizmusa
Az ÉN végződése (az 1. ábrán a sötét háromszög) látható kinagyítva, sematikusan. Az FN felől jövő ingerlés szerotonin (S) ingerátvivőt szabadít fel, mely az ÉN receptoraihoz kapcsolódva – G-fehérje közvetítésével – aktiválja az adenilát cikláz enzimet, amely ATP-ből cAMP-t állít elő. Utóbbi a protein kináz A-hoz kötődve azt aktiválja (PKAa), és az aktív kináz újabb ATP felhasználásával –P-csoportot köt a K+ csatornára, mire az bezárul. Ebben az állapotban az ÉN felől jövő ingerület hosszan tartja nyitva a kalciumcsatornát, több Ca2+ áramlik a végződésbe, ami fokozza a kis hólyagokból az MN felé történo ingerület-átvivő kiáramlást, ami tartós kopoltyú-összehúzódást eredményez. Az eredeti állapot visszaáll, ha a K+-csatornáról a –P csoportot protein foszfatáz enzimek lehasítják (ábrán nem látható).
3. ábra. Drosophila szag-áramütési tanulás
A készülék felső, átlyuggatott aljú csövébe (a) 80-100 muslicát tesznek, a csőre A szaganyagot tartalmazó edény illeszthető; egy vákuumrendszer e tanítócsövön szaganyaggal dúsított levegőt szív át. A tanítócső felülete egy elektromos rács, (60–90 V) ahol az állatok enyhe áramütést kapnak, ami kellemetlen, de nem károsító. A muslicákat háromszor egymás után kiteszik A szag + áramütés, illetve B szag hatásának áramütés nélkül. Ezután a készülékben lévő mozgatható kamrával (c) választási helyzetbe hozzák őket (alul): ekkor a két szagot egyszerre kapják két oldalról (áramütés nélkül). Egy perc múlva eloszlásukat a két csőben (b) meghatározzák. A tanulási index egyenlő az áramütéssel társított szagot elkerülő muslicák hányada mínusz a kontroll szagot elkerülők hányada: ennek értéke 1,0 (maximális tanulás) és 0 (a tanulás teljes hiánya) között változhat.
4. ábra. Memóriacsökkenés („felejtés”) dunce és vad típusú (Canton S) Drosophilákban
5. ábra. A cAMP anyagcsere sérülése két Drosophila memóriamutánsban
A cAMP szabályozásának anomáliái áttevődnek a PKA-katalizált foszforilációra, amely része a tanulás biokémiai reakcióláncának (vö. Aplysia-modell, 2. ábra).
6. ábra. CREB-fehérje szerepe HTM kialakulásában
A. Az RTM vázlata. Az ingerület-átvivő (NT) a receptoron kötődve cAMP-t termel, és megindítja a 2. ábra kaszkádját. Mindez az idegsejt citoplazmájában történik, a sejtmag pihen, a CREB fehérje inaktív.
B. HTM kialakulásakor az aktivált PKA bejut a sejtmagba, foszforilálja a CREB fehérjéket, ami elindítja a többlépcsős – korai-kései – gének kifejeződését.







Friss hozzászólások
7 év 27 hét
10 év 2 nap
10 év 4 hét
10 év 4 hét
10 év 5 hét
10 év 5 hét
10 év 5 hét
10 év 8 hét
10 év 8 hét
10 év 8 hét